碘钟反应
碘钟反应
6.1了,我们当然要出来水一水了(大雾)(其实是早就答应好的)那么这一期就来介绍一下碘钟反应及其机理。
碘钟反应
我们常说的碘钟反应大概分为两类:单向型、震荡型我们分开来介绍
单向型
单向型的碘钟反应

图片截取自YOUTUBE
常见的单向型的碘钟原理大致分为两种:
一、从碘酸盐开始,加入强还原剂(如硫代硫酸钠,亚(氢)硫酸钠等)将其直接还原为碘离子,待还原剂反应完毕后,过量的碘酸根和生成的碘离子生成碘单质(酸性环境)与碘粉结合变蓝(棕(取决于是直链淀粉还是支链淀粉))
二、从碘离子(碘三负离子)开始,加入强氧化剂(如过硫酸盐、氯酸盐高氯酸混合等)将其直接氧化为碘酸根,之后氧化剂消耗完毕后,发生归中反应。碘与淀粉变蓝(棕)
做法:同原理。嗯~ o(* ̄▽ ̄*)o
P.S.中间没有变化的原因大家可以思考一下
震荡型
震荡型的碘钟反应

up做哒(⊙﹏⊙)
这个先讲一下做法(●ˇ∀ˇ●)
配置甲溶液:量取97mL29%的过氧化氢溶液,转移入250mL容量瓶里,用蒸馏水稀释到刻度,得3.6mol/L过氧化氢溶液。
配置乙溶液:分别称取3.9g丙二酸和0.76g硫酸锰,分别溶于适量水中。另称取0.075g可溶性淀粉,溶于50mL左右沸水中。把三者转移入250mL容量瓶里,稀释到刻度,得到含0.15mol/L丙二酸、0.02mol/L硫酸锰、和0.03%淀粉的混合溶液。
配置丙溶液:称取10.75g碘酸钾溶于适量热水中,再加入40mL1mol/L硫酸溶液酸化。转移入250mL容量瓶里,稀释到刻度,得到0.2mol/L碘酸钾和0.08mol/L硫酸的混合溶液。
将甲、乙、丙三组溶液以等体积混合在锥形瓶中,这混合溶液分别含过氧化氢1.2mol/L、丙二酸0.05mol/L、硫酸锰0.0067mol/L、碘酸钾0.067mol/L、淀粉0.01%。混合后,反应液由无色变为蓝紫色,几秒后褪为无色,接着又称琥珀色变逐渐加深,蓝紫色又反复出现,几秒后又消失,这样周而复始地呈周期性变化。
原理:这个实验分为两个震荡步骤:a、碘单质与碘离子之间的震荡。b、二价锰与三价锰之间的震荡。
首先,碘酸根离子被过氧化氢依次还原成次碘酸根到碘离子
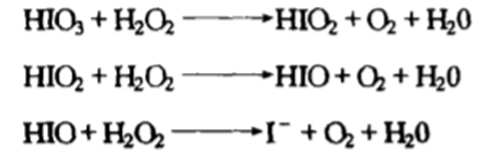
当碘离子浓度足够大时:
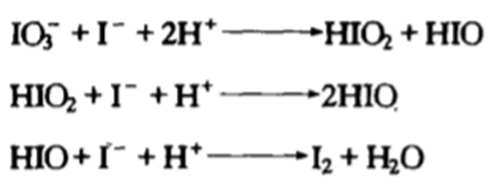
碘离子与次碘酸根碘酸根发生归中反应最终生成碘单质【变蓝】
随即生成的碘单质与丙二酸结合生成ICH(COOH)2同时碘离子减少【蓝色褪去】
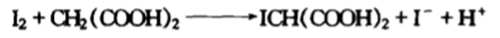
当碘离子浓度小到一定程度时(即ICH(COOH)2足够多时)
二价锰与次碘酸根(不稳定)反应生成三价锰,【变黄】
之后与ICH(COOH)2反应释放碘离子【黄色褪去】
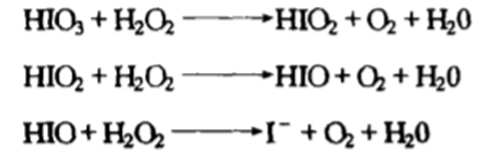
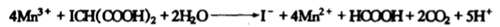
之后碘离子浓度上升回到第二步,这个过程中消耗丙二酸(变成甲酸),过氧化氢(还原碘酸根),碘酸钾。
之后我们捋一下:

来自海南师范学院学报截取
之后这个实验up就有视频了~( ̄▽ ̄)~*
结尾:下一期讲B-Z震荡(溴钟螺纹)(原本打算这期的,结果一看1200+的字了,算了(○´・д・)ノ)
最后祝大家六一快乐!高考同学考出好成绩!!!
以上就是(碘钟反应)全部内容,收藏起来下次访问不迷路!